Opioidy
Mianem opiatów określamy wszystkie naturalne związki egzogenne modulujące aktywność podstawową (ang. basal activity) receptorów opioidowych. Zaliczamy do nich wszystkie alkaloidy obecne w opium, takie jak: morfina, heroina, czy kodeina, oraz ich pochodne [1]. Substancje te wpływają silnie na układ nerwowy człowieka, prowadzą do stanów euforycznych jak i depresyjnych, wykazują silne działanie przeciwbólowe [2, 3]. Przyjmowanie opiatów może prowadzić do szybkiego uzależnienia [4]. Szerszym pojęciem określającym wszystkie związki wykazujące powinowactwo w stosunku do receptorów opioidowych są opioidy. Zaliczamy do nich zarówno opiaty, ich pochodne syntetyczne, jak i również endogenne ligandy peptydowe, takie jak endorfiny, enkefaliny, endomorfiny czy dynorfiny [5, 6].
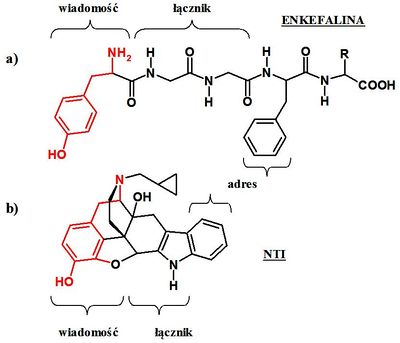
Endomorfiny, enkefaliny oraz dynorfiny, naturalne ligandy peptydowe receptorów opioidowych są cząsteczkami zbudowanymi z kilku do kilkudziesięciu aminokwasów. Ligandy te wykazują selektywność względem receptorów MOR, DOR oraz KOR. Peptydy te charakteryzuje wspólny motyw obecny od strony N-końca łańcucha peptydowego, sekwencja Tyr-Gly-Gly-Phe (lub Tyr-Pro-Phe/Trp-Phe) [6-9]. Według postulowanego modelu wiązania się ligandów, nazywanego potocznie: „wiadomość-adres” (ang. message-address) [10], wspólna dla peptydowych ligandów opioidowych sekwencja czterech aminokwasów jest odpowiedzialna za przekazanie sygnału – wiadomości. Pozostała część łańcucha polipeptydowego, specyficzna dla każdego liganda, odpowiada za selektywność względem danego typu receptora opioidowego – adres [11] (Rys. 1). Proponowany model oddziaływań zakłada, iż określony receptor posiada domenę odpowiedzialną za rozpoznawanie wspólnego dla ligandów opioidowych farmakoforu (modelu opisującego relacje przestrzenne między elementami wspólnymi dla ligandów oddziałujących z danym receptorem) oraz sąsiednie miejsce specyficzne dla danego typu receptora, odpowiadające za jego selektywność.
W oparciu o powyższy model wiązania peptydowych ligandów opioidowych podjęto próby zaprojektowania nowych związków wykazujących selektywność względem danego typu receptora MOR, DOR lub KOR [12-14]. Związki te składały się z trzech części: fragmentu odpowiedzialnego za „wiadomość”, którą była cząsteczka tyraminy (obecna zarówno w typowych alkaloidach jak morfina czy kodeina oraz w endogennych ligandach peptydowych), łącznika (np. szkieletu naśladującego sekwencje -Gly-Gly- ), oraz części odpowiedzialnej za „adres”, posiadającej podobne cechy do części adresowej endogennych ligandów peptydowych [12-14, 15 ] (Rys. 1).
Otrzymane ligandy wykazujące selektywność względem każdego z trzech typów receptorów opioidowych przyczyniły się do znacznego rozwoju badań nad mechanizmami wiązania się opioidów. Eksperymenty z zastosowaniem mutacji kierunkowych pozwoliły również na określenie miejsca wiązania tych ligandów oraz niektórych aminokwasów odpowiedzialnych za bezpośrednie oddziaływanie ligand-receptor, a także umożliwiły budowę nowych syntetycznych związków opioidowych [12, 14, 16-22]. Obecnie znana jest duża liczba ligandów niepeptydowych wykazujących powinowactwo do trzech typów receptorów opioidowych: MOR, KOR oraz DOR.
Zobacz też
Literatura
- Childers, S.R., et al., Opiate receptor binding affected differentially by opiates and opioid peptides. Eur J Pharmacol, 1979. 55(1): p. 11-8.
- Przewlocki, R. and B. Przewlocka, Opioids in chronic pain. Eur J Pharmacol, 2001. 429(1-3): p. 79-91.
- Trescot, A.M., et al., Opioid pharmacology. Pain Physician, 2008. 11(2 Suppl): p. S133-53.
- Raith, K. and G. Hochhaus, Drugs used in the treatment of opioid tolerance and physical dependence: a review. Int J Clin Pharmacol Ther, 2004. 42(4): p. 191-203.
- Cox, B.M., Endogenous opioid peptides: a guide to structures and terminology. Life Sci, 1982. 31(16-17): p. 1645-58.
- Okada, Y., et al., Endomorphins and related opioid peptides. Vitam Horm, 2002. 65: p. 257-79.
- Ling, N., R. Burgus, and R. Guillemin, Isolation, primary structure, and synthesis of alpha-endorphin and gamma-endorphin, two peptides of hypothalamic-hypophysial origin with morphinomimetic activity. Proc Natl Acad Sci U S A, 1976. 73(11): p. 3942-6.
- Chang, A.C., M. Cochet, and S.N. Cohen, Structural organization of human genomic DNA encoding the pro-opiomelanocortin peptide. Proc Natl Acad Sci U S A, 1980. 77(8): p. 4890-4.
- Noda, M., et al., Isolation and structural organization of the human preproenkephalin gene. Nature, 1982. 297(5865): p. 431-4.
- Schwyzer, R., ACTH: a short introductory review. Ann N Y Acad Sci, 1977. 297: p. 3-26.
- Chavkin, C. and A. Goldstein, Specific receptor for the opioid peptide dynorphin: structure--activity relationships. Proc Natl Acad Sci U S A, 1981. 78(10): p. 6543-7.
- Takemori, A.E. and P.S. Portoghese, Selective naltrexone-derived opioid receptor antagonists. Annu Rev Pharmacol Toxicol, 1992. 32: p. 239-69.
- Portoghese, P.S., et al., A highly selective delta 1-opioid receptor antagonist: 7-benzylidenenaltrexone. Eur J Pharmacol, 1992. 218(1): p. 195-6.
- Takemori, A.E., et al., Agonist and antagonist activities of ligands derived from naltrexone and oxymorphone. Life Sci, 1992. 50(20): p. 1491-5.
- Portoghese, P.S., M. Sultana, and A.E. Takemori, Design of peptidomimetic delta opioid receptor antagonists using the message-address concept. J Med Chem, 1990. 33(6): p. 1714-20.
- Befort, K., et al., Constitutive activation of the delta opioid receptor by mutations in transmembrane domains III and VII. J Biol Chem, 1999. 274(26): p. 18574-81.
- Bot, G., et al., Mutagenesis of a single amino acid in the rat mu-opioid receptor discriminates ligand binding. J Neurochem, 1998. 70(1): p. 358-65.
- Bot, G., et al., Mutagenesis of the mouse delta opioid receptor converts (-)-buprenorphine from a partial agonist to an antagonist. J Pharmacol Exp Ther, 1998. 284(1): p. 283-90.
- Spivak, C.E., et al., Naloxone activation of mu-opioid receptors mutated at a histidine residue lining the opioid binding cavity. Mol Pharmacol, 1997. 52(6): p. 983-92.
- Mansour, A., et al., Key residues defining the mu-opioid receptor binding pocket: a site-directed mutagenesis study. J Neurochem, 1997. 68(1): p. 344-53.
- Befort, K., et al., Role of aromatic transmembrane residues of the delta-opioid receptor in ligand recognition. J Biol Chem, 1996. 271(17): p. 10161-8.
- Befort, K., et al., The conserved aspartate residue in the third putative transmembrane domain of the delta-opioid receptor is not the anionic counterpart for cationic opiate binding but is a constituent of the receptor binding site. Mol Pharmacol, 1996. 49(2): p. 216-23.