(→Zobacz też) |
|||
| (Nie pokazano 57 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
| − | == | + | == GPCR (''ang. G protein coupled receptors'') - receptory sprzężone z białkami G == |
| − | + | '''Receptory sprzężone z białkami G''' (GPCRs – ''ang. G protein coupled receptors'') stanowią najliczniejszą i bardzo zróżnicowaną grupę białek błonowych odpowiedzialnych za przekazywanie sygnałów przez dwuwarstwę lipidową do miejsc efektorowych znajdujących się we wnętrzu komórki [1]. Sekwencjonowanie ludzkiego genomu ujawniło występowanie ok. 800 różnych typów receptorów należących do rodziny GPCR (geny kodujące receptory GPCR stanowią powyżej 3% ludzkiego genomu), a ponad połowa z nich wykazuje potencjalne znaczenie dla przemysłu farmaceutycznego [2, 3]. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | Analiza porównawcza sekwencji receptorów GPCR oraz badania funkcji poszczególnych typów receptorów doprowadziły do podziału tej rodziny białek na klasy, które oznaczono literami od A do F [4, 5]. Pierwsza, najliczniejsza klasa A (nazywana również klasą podobnych do rodopsyny – ''ang. rhodopsin like''), obejmująca ponad 80% wszystkich GPCR, to klasa receptorów rodopsyno-podobnych. Receptory wchodzące w skład tej grupy są jednymi z najlepiej zbadanych. Zaliczamy do nich, obok rodopsyny, między innymi: receptory adrenergiczne, opioidowe, adenozynowe, kanabinoidowe, receptory chemokin, dopaminowe i histaminowe. Klasę B stanowią receptory sekretyno-podobne. Do klasy C zaliczamy receptory glutaminergiczne i feromonowe. Kolejne klasy D i E tworzą odpowiednio receptory feromonów grzybów oraz receptory cAMP. Ostatnia klasa F to receptory frizzled/smoothened. Klasyfikacja ta pokrywa się w większości z nową klasyfikacją GRAFS [6], opartą na badaniach filogenetycznych. Nazwa GRAFS pochodzi od pierwszych liter wyodrębnionych rodzin receptorów, do których należą odpowiednio: receptory Glutaminergiczne, Rodopsyno-podobne, Adhezyjne, Frizzled i smakowe oraz Sekretyno-podobne. | ||
| + | Receptory sprzężone z białkami G uczestniczą w kaskadach sygnalizacyjnych pośrednicząc w przekazywaniu informacji przez liczne zewnątrzkomórkowe cząsteczki sygnałowe: hormony, przekaźniki neuronalne, małe białka, krótkie łańcuchy peptydowe, aminy, lipidy, nukleotydy czy pochodne aminokwasów i kwasów tłuszczowych [3, 7]. Dla każdej z wymienionych substancji istnieje receptor, bądź też grupa receptorów mogąca wiązać daną cząsteczkę, inicjującą jednocześnie przekazanie sygnału przez błonę komórkową. Receptory GPCR odgrywają kluczową rolę w wielu procesach fizjologicznych regulujących prace komórki, jej metabolizm, wzrost i obronę immunologiczną. Receptory sprzężone z białkami G pełnią ponadto bardzo różnorodne funkcje w organizmie człowieka. Zaliczamy do nich między innymi: rodopsynę [8, 9], białko fotoreceptorowe aktywowane przez światło, uczestniczące w procesie widzenia, receptory adrenergiczne [10-12] wywierające wpływ na ciśnienie tętnicze, receptory opioidowe [13, 14] modulujące poziom odczuwanego bólu, receptory muskarynowe kontrolujące pracę mięsni gładkich, a także receptory smakowe oraz węchowe. | ||
| + | |||
| + | [[Image:GPCR schemat.jpg|thumb|upright|500px| Rys. 1. Schemat budowy receptora GPCR oraz jego lokalizacja w błonie komórkowej, IL:I do IL:III - pętle wewnątrzkomórkowe, EL:I do EL:III – pętle zewnątrzkomórkowe, helisy transbłonowe oznaczono cyframi od I do VII. N-koniec położony jest po stronie zewnątrzkomórkowej, C-koniec znajduje się po stronie cytoplazmatycznej błony. Rysunek wykonany na podstawie pracy [15]]] | ||
| − | + | Niezależnie od pełnionych funkcji oraz różnic w długości łańcucha białkowego receptory GPCR posiadają wspólne cechy strukturalne. Wszystkie zbudowane są z pojedynczego łańcucha polipeptydowego siedmiokrotnie przechodzącego przez dwuwarstwę lipidową (Rys. 1). Domenę transbłonową wszystkich receptorów GPCR tworzy siedem hydrofobowych α-helis (TMH:I do TMH:VII) połączonych pętlami, trzy pętle na zewnątrz komórki (EL:I do EL:III) oraz trzy wewnątrz komórki (IL:I do IL:III)). Koniec karboksylowy (C-koniec) znajduje się zawsze po stronie cytozolowej błony i zawiera miejsca fosforylacji przez odpowiednie kinazy GRK (''ang. G protein coupled Receptor Kinase''). Mający wolną grupę aminową koniec łańcucha białkowego (N-koniec) położony jest zawsze na zewnątrz komórki i zwykle zawiera miejsca glikozylacji. Na znajdującej się po obu stronach błony komórkowej powierzchni receptora, występują liczne aminokwasy o charakterze hydrofilowym, natomiast w obszarze błony przeważają aminokwasy o właściwościach hydrofobowych co powoduje silne zakotwiczenie białka w błonie lipidowej. Obecne pomiędzy helisami liczne wiązania wodorowe dodatkowo stabilizują strukturę receptorów GPCR. | |
| + | Receptory sprzężone z białkami G wykazują duże podobieństwo sekwencyjne i strukturalne w rejonie transbłonowym [11, 16-20], natomiast długość łańcucha białkowego w obszarze N- jak i C-końca oraz pętli łączących helisy podlega dużemu zróżnicowaniu [21]. Znikome podobieństwo sekwencyjne tych fragmentów pozwala również przypuszczać, iż posiadają one odmienną strukturę przestrzenną, szczególnie w części zewnątrzkomórkowej (która wiąże odmienne ligandy), podczas gdy są one zadziwiająco podobne pod względem długości pętli w części cytoplazmatycznej (która służy do wiązania trimeru białka G). | ||
| + | |||
| + | Miejsce wiązania ligandów receptorów rodziny A zlokalizowane jest przeważnie we wnęce tworzonej przez siedem α-helis, jak ma to miejsce w przypadku receptora b2 adrenergicznego [10] czy rodopsyny [8]. Bezpośrednie otocznie miejsca aktywnego stanowią aminokwasy pochodzące z helis transmembranowych TMH:I, TMH:III, ,TMH:V, TMH:VI, oraz TMH:VII. W niektórych typach receptorów GPCR ligandy wiążą się również do dużej domeny tworzonej przez długi N-koniec receptora (receptory feromonów, receptory GABAB), [22, 23] jak i do aminokwasów zlokalizowanych w pętlach i w obszarze transmembranowym białka receptorowego (receptory neuropeptydowe) [1, 7, 24, 25]. | ||
| − | + | Poznane dotychczas struktury krystaliczne receptorów GPCR (struktury rodopsyny nieaktywnej [8], struktura rodopsyny częściowo aktywnej [26], struktury opsyny [16], struktura receptora A2A adenozynowego [18], struktury receptora β1 adrenergicznego [11] oraz receptora β2 adrenergicznego [10]) stanowią receptory należące do klasy A, rodopsyno-podobnych. Pomimo faktu, iż podobieństwo sekwencyjne nie jest duże dla różnych typów receptorów klasy A (20-30% dla całej długości łańcucha białkowego), prezentowane struktury wykazują wysoką zbieżność w obszarze transbłonowym (po wzajemnym nałożeniu części łańcucha białkowego, wspólnego dla obszaru transmembranowego receptora β2 adrenergicznego oraz rodopsyny, średnie odchylenie kwadratowe położenia współrzędnych atomów białka (RMSD) nie przekracza 3.2 Å). Wysokie podobieństwo strukturalne tego obszaru sugeruje, że proces przeniesienia sygnału przez błonę komórkową inicjowany aktywacją receptora może posiadać wspólny mechanizm dla większości przedstawicieli tej rodziny | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Zobacz też == | == Zobacz też == | ||
| − | * [[ | + | * [[GPCR – struktury krystaliczne]] |
| − | + | * [[Białko G ]] | |
| − | + | * [[Receptory ]] | |
| − | + | * [[Receptory błonowe ]] | |
| − | + | * [[Receptory serotoninowe ]] | |
| − | * [[ | + | * [[Receptory opioidowe]] |
| − | * | + | * [[Rodopsyna]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | * [ | ||
| − | * [ | ||
| − | |||
| − | [[ | ||
| − | + | == Literatura == | |
| + | # Pierce, K.L., R.T. Premont, and R.J. Lefkowitz, Seven-transmembrane receptors. Nat Rev Mol Cell Biol, 2002. 3(9): p. 639-50. | ||
| + | # George, S.R., B.F. O'Dowd, and S.P. Lee, G-protein-coupled receptor oligomerization and its potential for drug discovery. Nat Rev Drug Discov, 2002. 1(10): p. 808-20. | ||
| + | # Horn, F., et al., GPCRDB information system for G protein-coupled receptors. Nucleic Acids Res, 2003. 31(1): p. 294-7. | ||
| + | # Foord, S.M., et al., International Union of Pharmacology. XLVI. G protein-coupled receptor list. Pharmacol Rev, 2005. 57(2): p. 279-88. | ||
| + | # Attwood, T.K. and J.B. Findlay, Fingerprinting G-protein-coupled receptors. Protein Eng, 1994. 7(2): p. 195-203. | ||
| + | # Schioth, H.B. and R. Fredriksson, The GRAFS classification system of G-protein coupled receptors in comparative perspective. Gen Comp Endocrinol, 2005. 142(1-2): p. 94-101. | ||
| + | # Kristiansen, K., Molecular mechanisms of ligand binding, signaling, and regulation within the superfamily of G-protein-coupled receptors: molecular modeling and mutagenesis approaches to receptor structure and function. Pharmacol Ther, 2004. 103(1): p. 21-80. | ||
| + | # Palczewski, K., et al., Crystal structure of rhodopsin: A G protein-coupled receptor. Science, 2000. 289(5480): p. 739-45. | ||
| + | # Filipek, S., et al., G protein-coupled receptor rhodopsin: a prospectus. Annu Rev Physiol, 2003. 65: p. 851-79. | ||
| + | # Cherezov, V., et al., High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science, 2007. 318(5854): p. 1258-65. | ||
| + | # Warne, T., et al., Structure of a beta(1)-adrenergic G-protein-coupled receptor. Nature, 2008. | ||
| + | # Taira, C.A., et al., Therapeutic implications of beta-adrenergic receptor pharmacodynamic properties. Curr Clin Pharmacol, 2008. 3(3): p. 174-84. | ||
| + | # Trescot, A.M., et al., Opioid pharmacology. Pain Physician, 2008. 11(2 Suppl): p. S133-53. | ||
| + | # Corbett, A.D., et al., 75 years of opioid research: the exciting but vain quest for the Holy Grail. Br J Pharmacol, 2006. 147 Suppl 1: p. S153-62. | ||
| + | # Davis, M.P., S.B. LeGrand, and R. Lagman, Look before leaping: combined opioids may not be the rave. Support Care Cancer, 2005. 13(10): p. 769-74. | ||
| + | # Park, J.H., et al., Crystal structure of the ligand-free G-protein-coupled receptor opsin. Nature, 2008. 454(7201): p. 183-7. | ||
| + | # Scheerer, P., et al., Crystal structure of opsin in its G-protein-interacting conformation. Nature, 2008. 455(7212): p. 497-502. | ||
| + | # Jaakola, V.P., et al., The 2.6 angstrom crystal structure of a human A2A adenosine receptor bound to an antagonist. Science, 2008. 322(5905): p. 1211-7. | ||
| + | # Rosenbaum, D.M., et al., GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function. Science, 2007. 318(5854): p. 1266-73. | ||
| + | # Rasmussen, S.G., et al., Crystal structure of the human beta2 adrenergic G-protein-coupled receptor. Nature, 2007. 450(7168): p. 383-7. | ||
| + | # Mirzadegan, T., et al., Sequence analyses of G-protein-coupled receptors: similarities to rhodopsin. Biochemistry, 2003. 42(10): p. 2759-2767. | ||
| + | # Pin, J.P., T. Galvez, and L. Prezeau, Evolution, structure, and activation mechanism of family 3/C G-protein-coupled receptors. Pharmacol Ther, 2003. 98(3): p. 325-54. | ||
| + | # Felder, C.B., et al., The Venus flytrap of periplasmic binding proteins: an ancient protein module present in multiple drug receptors. AAPS PharmSci, 1999. 1(2): p. E2. | ||
| + | # Gether, U., Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev, 2000. 21(1): p. 90-113. | ||
| + | # Bohn, L.M., et al., Mu-opioid receptor desensitization by beta-arrestin-2 determines morphine tolerance but not dependence. Nature, 2000. 408(6813): p. 720-3. | ||
| + | # Salom, D., et al., Crystal structure of a photoactivated deprotonated intermediate of rhodopsin. Proc Natl Acad Sci U S A, 2006. 103(44): p. 16123-8. | ||
Aktualna wersja na dzień 02:31, 27 sty 2012
GPCR (ang. G protein coupled receptors) - receptory sprzężone z białkami G
Receptory sprzężone z białkami G (GPCRs – ang. G protein coupled receptors) stanowią najliczniejszą i bardzo zróżnicowaną grupę białek błonowych odpowiedzialnych za przekazywanie sygnałów przez dwuwarstwę lipidową do miejsc efektorowych znajdujących się we wnętrzu komórki [1]. Sekwencjonowanie ludzkiego genomu ujawniło występowanie ok. 800 różnych typów receptorów należących do rodziny GPCR (geny kodujące receptory GPCR stanowią powyżej 3% ludzkiego genomu), a ponad połowa z nich wykazuje potencjalne znaczenie dla przemysłu farmaceutycznego [2, 3].
Analiza porównawcza sekwencji receptorów GPCR oraz badania funkcji poszczególnych typów receptorów doprowadziły do podziału tej rodziny białek na klasy, które oznaczono literami od A do F [4, 5]. Pierwsza, najliczniejsza klasa A (nazywana również klasą podobnych do rodopsyny – ang. rhodopsin like), obejmująca ponad 80% wszystkich GPCR, to klasa receptorów rodopsyno-podobnych. Receptory wchodzące w skład tej grupy są jednymi z najlepiej zbadanych. Zaliczamy do nich, obok rodopsyny, między innymi: receptory adrenergiczne, opioidowe, adenozynowe, kanabinoidowe, receptory chemokin, dopaminowe i histaminowe. Klasę B stanowią receptory sekretyno-podobne. Do klasy C zaliczamy receptory glutaminergiczne i feromonowe. Kolejne klasy D i E tworzą odpowiednio receptory feromonów grzybów oraz receptory cAMP. Ostatnia klasa F to receptory frizzled/smoothened. Klasyfikacja ta pokrywa się w większości z nową klasyfikacją GRAFS [6], opartą na badaniach filogenetycznych. Nazwa GRAFS pochodzi od pierwszych liter wyodrębnionych rodzin receptorów, do których należą odpowiednio: receptory Glutaminergiczne, Rodopsyno-podobne, Adhezyjne, Frizzled i smakowe oraz Sekretyno-podobne.
Receptory sprzężone z białkami G uczestniczą w kaskadach sygnalizacyjnych pośrednicząc w przekazywaniu informacji przez liczne zewnątrzkomórkowe cząsteczki sygnałowe: hormony, przekaźniki neuronalne, małe białka, krótkie łańcuchy peptydowe, aminy, lipidy, nukleotydy czy pochodne aminokwasów i kwasów tłuszczowych [3, 7]. Dla każdej z wymienionych substancji istnieje receptor, bądź też grupa receptorów mogąca wiązać daną cząsteczkę, inicjującą jednocześnie przekazanie sygnału przez błonę komórkową. Receptory GPCR odgrywają kluczową rolę w wielu procesach fizjologicznych regulujących prace komórki, jej metabolizm, wzrost i obronę immunologiczną. Receptory sprzężone z białkami G pełnią ponadto bardzo różnorodne funkcje w organizmie człowieka. Zaliczamy do nich między innymi: rodopsynę [8, 9], białko fotoreceptorowe aktywowane przez światło, uczestniczące w procesie widzenia, receptory adrenergiczne [10-12] wywierające wpływ na ciśnienie tętnicze, receptory opioidowe [13, 14] modulujące poziom odczuwanego bólu, receptory muskarynowe kontrolujące pracę mięsni gładkich, a także receptory smakowe oraz węchowe.
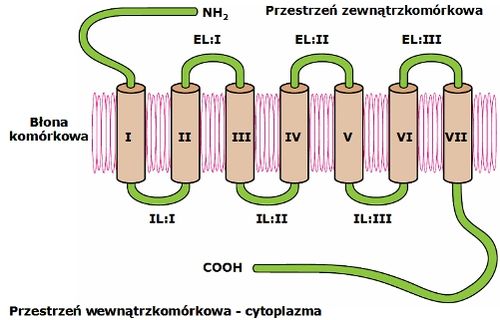
Niezależnie od pełnionych funkcji oraz różnic w długości łańcucha białkowego receptory GPCR posiadają wspólne cechy strukturalne. Wszystkie zbudowane są z pojedynczego łańcucha polipeptydowego siedmiokrotnie przechodzącego przez dwuwarstwę lipidową (Rys. 1). Domenę transbłonową wszystkich receptorów GPCR tworzy siedem hydrofobowych α-helis (TMH:I do TMH:VII) połączonych pętlami, trzy pętle na zewnątrz komórki (EL:I do EL:III) oraz trzy wewnątrz komórki (IL:I do IL:III)). Koniec karboksylowy (C-koniec) znajduje się zawsze po stronie cytozolowej błony i zawiera miejsca fosforylacji przez odpowiednie kinazy GRK (ang. G protein coupled Receptor Kinase). Mający wolną grupę aminową koniec łańcucha białkowego (N-koniec) położony jest zawsze na zewnątrz komórki i zwykle zawiera miejsca glikozylacji. Na znajdującej się po obu stronach błony komórkowej powierzchni receptora, występują liczne aminokwasy o charakterze hydrofilowym, natomiast w obszarze błony przeważają aminokwasy o właściwościach hydrofobowych co powoduje silne zakotwiczenie białka w błonie lipidowej. Obecne pomiędzy helisami liczne wiązania wodorowe dodatkowo stabilizują strukturę receptorów GPCR.
Receptory sprzężone z białkami G wykazują duże podobieństwo sekwencyjne i strukturalne w rejonie transbłonowym [11, 16-20], natomiast długość łańcucha białkowego w obszarze N- jak i C-końca oraz pętli łączących helisy podlega dużemu zróżnicowaniu [21]. Znikome podobieństwo sekwencyjne tych fragmentów pozwala również przypuszczać, iż posiadają one odmienną strukturę przestrzenną, szczególnie w części zewnątrzkomórkowej (która wiąże odmienne ligandy), podczas gdy są one zadziwiająco podobne pod względem długości pętli w części cytoplazmatycznej (która służy do wiązania trimeru białka G).
Miejsce wiązania ligandów receptorów rodziny A zlokalizowane jest przeważnie we wnęce tworzonej przez siedem α-helis, jak ma to miejsce w przypadku receptora b2 adrenergicznego [10] czy rodopsyny [8]. Bezpośrednie otocznie miejsca aktywnego stanowią aminokwasy pochodzące z helis transmembranowych TMH:I, TMH:III, ,TMH:V, TMH:VI, oraz TMH:VII. W niektórych typach receptorów GPCR ligandy wiążą się również do dużej domeny tworzonej przez długi N-koniec receptora (receptory feromonów, receptory GABAB), [22, 23] jak i do aminokwasów zlokalizowanych w pętlach i w obszarze transmembranowym białka receptorowego (receptory neuropeptydowe) [1, 7, 24, 25].
Poznane dotychczas struktury krystaliczne receptorów GPCR (struktury rodopsyny nieaktywnej [8], struktura rodopsyny częściowo aktywnej [26], struktury opsyny [16], struktura receptora A2A adenozynowego [18], struktury receptora β1 adrenergicznego [11] oraz receptora β2 adrenergicznego [10]) stanowią receptory należące do klasy A, rodopsyno-podobnych. Pomimo faktu, iż podobieństwo sekwencyjne nie jest duże dla różnych typów receptorów klasy A (20-30% dla całej długości łańcucha białkowego), prezentowane struktury wykazują wysoką zbieżność w obszarze transbłonowym (po wzajemnym nałożeniu części łańcucha białkowego, wspólnego dla obszaru transmembranowego receptora β2 adrenergicznego oraz rodopsyny, średnie odchylenie kwadratowe położenia współrzędnych atomów białka (RMSD) nie przekracza 3.2 Å). Wysokie podobieństwo strukturalne tego obszaru sugeruje, że proces przeniesienia sygnału przez błonę komórkową inicjowany aktywacją receptora może posiadać wspólny mechanizm dla większości przedstawicieli tej rodziny
Zobacz też
- GPCR – struktury krystaliczne
- Białko G
- Receptory
- Receptory błonowe
- Receptory serotoninowe
- Receptory opioidowe
- Rodopsyna
Literatura
- Pierce, K.L., R.T. Premont, and R.J. Lefkowitz, Seven-transmembrane receptors. Nat Rev Mol Cell Biol, 2002. 3(9): p. 639-50.
- George, S.R., B.F. O'Dowd, and S.P. Lee, G-protein-coupled receptor oligomerization and its potential for drug discovery. Nat Rev Drug Discov, 2002. 1(10): p. 808-20.
- Horn, F., et al., GPCRDB information system for G protein-coupled receptors. Nucleic Acids Res, 2003. 31(1): p. 294-7.
- Foord, S.M., et al., International Union of Pharmacology. XLVI. G protein-coupled receptor list. Pharmacol Rev, 2005. 57(2): p. 279-88.
- Attwood, T.K. and J.B. Findlay, Fingerprinting G-protein-coupled receptors. Protein Eng, 1994. 7(2): p. 195-203.
- Schioth, H.B. and R. Fredriksson, The GRAFS classification system of G-protein coupled receptors in comparative perspective. Gen Comp Endocrinol, 2005. 142(1-2): p. 94-101.
- Kristiansen, K., Molecular mechanisms of ligand binding, signaling, and regulation within the superfamily of G-protein-coupled receptors: molecular modeling and mutagenesis approaches to receptor structure and function. Pharmacol Ther, 2004. 103(1): p. 21-80.
- Palczewski, K., et al., Crystal structure of rhodopsin: A G protein-coupled receptor. Science, 2000. 289(5480): p. 739-45.
- Filipek, S., et al., G protein-coupled receptor rhodopsin: a prospectus. Annu Rev Physiol, 2003. 65: p. 851-79.
- Cherezov, V., et al., High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science, 2007. 318(5854): p. 1258-65.
- Warne, T., et al., Structure of a beta(1)-adrenergic G-protein-coupled receptor. Nature, 2008.
- Taira, C.A., et al., Therapeutic implications of beta-adrenergic receptor pharmacodynamic properties. Curr Clin Pharmacol, 2008. 3(3): p. 174-84.
- Trescot, A.M., et al., Opioid pharmacology. Pain Physician, 2008. 11(2 Suppl): p. S133-53.
- Corbett, A.D., et al., 75 years of opioid research: the exciting but vain quest for the Holy Grail. Br J Pharmacol, 2006. 147 Suppl 1: p. S153-62.
- Davis, M.P., S.B. LeGrand, and R. Lagman, Look before leaping: combined opioids may not be the rave. Support Care Cancer, 2005. 13(10): p. 769-74.
- Park, J.H., et al., Crystal structure of the ligand-free G-protein-coupled receptor opsin. Nature, 2008. 454(7201): p. 183-7.
- Scheerer, P., et al., Crystal structure of opsin in its G-protein-interacting conformation. Nature, 2008. 455(7212): p. 497-502.
- Jaakola, V.P., et al., The 2.6 angstrom crystal structure of a human A2A adenosine receptor bound to an antagonist. Science, 2008. 322(5905): p. 1211-7.
- Rosenbaum, D.M., et al., GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function. Science, 2007. 318(5854): p. 1266-73.
- Rasmussen, S.G., et al., Crystal structure of the human beta2 adrenergic G-protein-coupled receptor. Nature, 2007. 450(7168): p. 383-7.
- Mirzadegan, T., et al., Sequence analyses of G-protein-coupled receptors: similarities to rhodopsin. Biochemistry, 2003. 42(10): p. 2759-2767.
- Pin, J.P., T. Galvez, and L. Prezeau, Evolution, structure, and activation mechanism of family 3/C G-protein-coupled receptors. Pharmacol Ther, 2003. 98(3): p. 325-54.
- Felder, C.B., et al., The Venus flytrap of periplasmic binding proteins: an ancient protein module present in multiple drug receptors. AAPS PharmSci, 1999. 1(2): p. E2.
- Gether, U., Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev, 2000. 21(1): p. 90-113.
- Bohn, L.M., et al., Mu-opioid receptor desensitization by beta-arrestin-2 determines morphine tolerance but not dependence. Nature, 2000. 408(6813): p. 720-3.
- Salom, D., et al., Crystal structure of a photoactivated deprotonated intermediate of rhodopsin. Proc Natl Acad Sci U S A, 2006. 103(44): p. 16123-8.